资源库目录
|
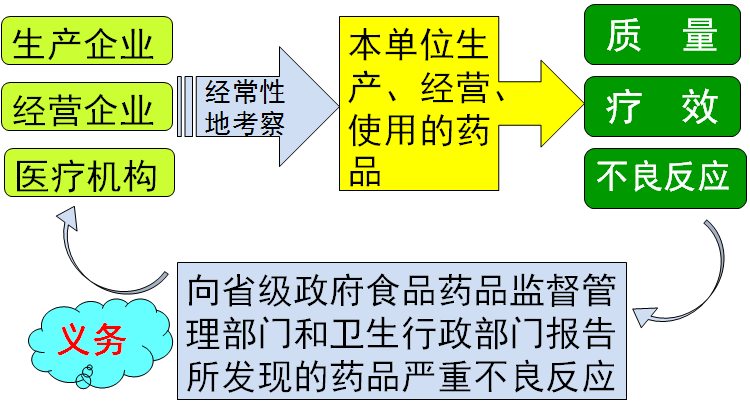
中华人民共和国药品管理法(释义) 第八章 药品监督 第七十条 不良反应 学习要点: 1.掌握药品不良反应监测报告制度和处理程序的规定 2.了解药品不良反应和严重不良反应的内容 第七十条(内容) 国家实行药品不良反应报告制度。药品生产企业、药品经营企业和医疗机构必须经常考察本单位所生产、经营、使用的药品质量、疗效和反应。发现可能与用药有关的严重不良反应,必须及时向当地省、自治区、直辖市人民政府食品药品监督管理部门和卫生行政部门报告。具体办法由国务院食品药品监督管理部门会同国务院卫生行政部门制定。 对已确认发生严重不良反应的药品,国务院或者省、自治区、直辖市人民政府的药品监督管理部门可以采取停止生产、销售、使用的紧急控制措施,并应当在5日内组织鉴定,自鉴定结论作出之日起15日内依法作出行政处理决定。 主旨: 本条是关于药品不良反应监测报告制度和处理程序的规定。
释义: 一、本条第一款规定了国家实行药品不良反应监测报告制度。 所谓“药品不良反应”,是指合格药品在正常用法用量下出现的与用药目的无关的或意外的有害反应。
药品不良反应包括: ①对人体有害的副作用 ②毒性作用 ③过敏反应 ④药物依赖性 ⑤致突变、致畸、致癌 ⑥其他不良反应 二、随着医药科学的飞速发展,药品品种日益增多。 药品不良反应监测和报告制度的建立,可为评价、清理、改进或者淘汰药品提供重要的科学依据,也是维护人民用药安全的一项切实可行的重要措施。 三、按照本条第一款的规定,经常性地考察本单位生产、经营、使用的药品的质量、疗效和不良反应,并向省级政府食品药品监督管理部门和卫生行政部门报告所发现的药品严重不良反应,是药品生产企业 、经营企业和医疗机构的法定义务。
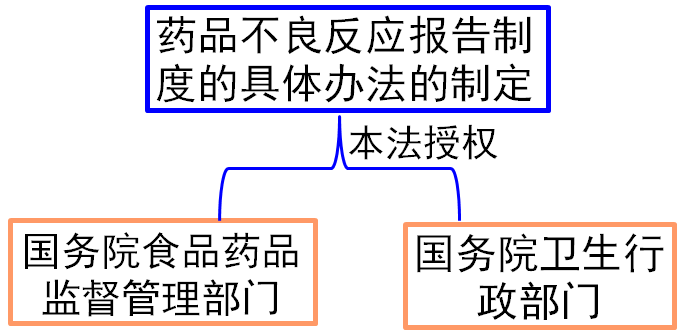
四、按照本条规定,当药品生产企业、药品经营企业、医疗机构发现可能与用药有关的严重不良反应时,必须及时向当地省、自治区、直辖市食品药品监督管理部门和卫生行政部门报告。 这里的“严重不良反应”主要包括: 1.因服用药品引起死亡的 2.因服用药品引发癌症或致畸的 3.因服用药品损害了重要生命器官,威胁生命或丧失正常生活能力的 4.因服用药品引起了身体损害而导致住院治疗的 5.因药品不良反应延长了住院治疗时间的等 五、对于药品不良反应报告制度的具体办法,本法授权由国务院食品药品监督管理部门会同国务院卫生行政部门制定。
六、本条第二款规定了对已确认发生严重不良反应的药品的处理程序。 1.国务院或省、自治区、直辖市人民政府的食品药品监督管理部门可以采取停止生产、销售、使用的紧急控制措施。 2.国务院或省、自治区、直辖市人民政府的食品药品监督管理部门对已确认发生严重不良反应的药品除采取停止生产、销售、使用的紧急控制措施外,还应当在五日内组织鉴定,为作出行政处理提供技术依据。 3.有关食品药品监督管理部门应当自鉴定结论作出之日起十五日内依法作出行政处理决定。 行政处理决定包括两种情况: ⑴经过鉴定后认为继续使用该药品不能保证用药者安全的,或者有其他药品可以取代的,可依照本法第四十二条的规定,由国务院食品药品监督管理部门撤销该药品的批准文号或者进口药品注册证书;已经生产或进口的,由当地食品药品监督管理部门监督销毁或处理。 ⑵综合考虑,以最大可能保证用药安全为前提,在可控制的条件下继续使用该药品,如采取修改说明书,调整用法用量、增加注意事项和给以特别警示等措施后,撤销对该药品的紧急控制措施。 |
||||||||


 028-84723155
028-84723155 四川省成都市一环路东三段64号
四川省成都市一环路东三段64号 kaoshixitong@126.com
kaoshixitong@126.com